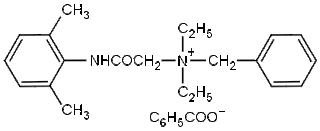Ποια είναι η πιο πικρή ουσία;
Δενατόνιο (βενζοϊκό)
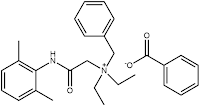
Βενζοϊκό Ν-βενζυλο-2-(2,6-διμεθυλοφαινυλαμινο)-Ν,Ν-διαιθυλο-2-οξοαιθαναμίνιο
Denatonium benzoate (BitrexTM)
N-benzyl-2-(2,6-dimethylphenylamino)-N,N-diethyl-2-oxoethanaminium
benzoate
 Εμφάνιση:
Λευκή κρυσταλλική ουσία
Εμφάνιση:
Λευκή κρυσταλλική ουσία
Μοριακός
τύπος: C21H29Ν2O.C7H5O2
Σχετική
μοριακή μάζα: 446,58
Σημείο
τήξης: 166-170οC
pH υδατ. διαλύματος 3%: 6,5-7,5
Διαλυτότητα
(g/100 mL, στους 20οC):
- Νερό:
4,5
-
Αιθανόλη: 33,5
-
Βουτανόλη: 20,8
-
Ακετόνη: 1,4
-
Αιθέρας: 0,015
-
Βενζόλιο: 0,49
Βενζοϊκό δενατόνιο:
Η ένωση βενζοϊκό δενατόνιο (ΒΔ) (denatonium benzoate) έχει την εξαιρετικά
ενδιαφέρουσα ιδιότητα να είναι η ουσία με την πιο ισχυρή πικρή γεύση μεταξύ των
γνωστών χημικών ουσιών. Από χημική άποψη πρόκειται για ένα άλας
αποτελούμενο από ένα οργανικό κατιόν τεταρτοταγούς αμμωνίου και από ένα
οργανικό ανιόν, το ανιόν του βενζοϊκού οξεός. Tο βενζοϊκό ανιόν δεν
συνεισφέρει ουσιαστικά στην πικρή γεύση της ένωσης και συχνά
αντικαθίσταται από το ανιόν της συνθετικής γλυκαντικής ύλης σακχαρίνης
(denatonium saccharide) [Αναφ.
3-5]. Η ονομασία της ένωσης προέρχεται από τη
λέξη "denaturation" (μετουσίωση) και την κατάληξη "onium"
που υποδηλώνει κατιόν τεταρτοταγούς αμμωνίου (R4N+).
Το ΒΔ ανακαλύφθηκε το 1958 (MacFarlan Smith, Εδιμβούργο) κατά τη διάρκεια πειραμάτων παρασκευής νέων
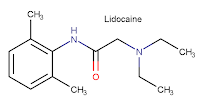
αναισθητικών ουσιών. Η δομή του δενατονίου μοιάζει αρκετά με το τοπικό
αναισθητικό λιδοκαΐνη (lidocaine)
(γνωστή και ως ξυλοκαΐνη), η οποία έχει επίσης εξαιρετικά πικρή
γεύση και διαθέτει ουσιαστικά την ίδια χημική δομή και υπολείπεται μόνο κατά
μία βενζυλική ομάδα (-CH2C6H5).
Που
χρησιμοποιείται;
Μια από τις κυριότερες χρήσεις του ΒΔ είναι η μετουσίωση της
αιθανόλης. Έτσι, στην αιθανόλη η οποία χρησιμοποιείται ως διαλύτης ή καύσιμο
("φωτιστικό οινόπνευμα" ή "μπλε οινόπνευμα"), προστίθεται
μεθανόλη, πυριδινικές ενώσεις, πετρέλαιο, χρώμα και άλλα συστατικά (νομοθετικώς
προβλεπόμενα από κάθε κράτος) για να αποτραπεί η παράνομη χρήση της για την
παρασκευή αλκοολούχων ποτών, εφόσον η αιθανόλη για τη χρήση αυτή υπόκειται σε
υψηλούς φόρους. Πολλοί εθνικοί κανονισμοί προβλέπουν και την προσθήκη ΒΔ για να
αποτραπεί η κατά λάθος κατάποση της μετουσιωμένης αιθανόλης.
Στο εμπόριο το ΒΔ διατίθεται ως καθαρή ένωση με την εμπορική ονομασία BITREX (από
το bitter: πικρό) ή AVERSION (aversion: αποστροφή,
αντιπάθεια), αλλά και ως διάλυμα 20% σε αιθανόλη ή αιθυλενογλυκόλη.
Η χρήση του ΒΔ είναι υποχρεωτική σε ορισμένα τοξικά προϊόντα για
λόγους ασφαλείας, γιατί τα καθιστά τόσο πικρά και απωθητικά στη γεύση που ο
άνθρωπος ή τα ζώα δεν μπορούν να τα καταπιούν. Χαρακτηριστικά αναφέρεται
ότι η πικρή γεύση του ΒΔ γίνεται αντιληπτή ακόμη και σε αραίωση 1:50.000.000.
Συνήθως επαρκεί μια συγκέντρωση 10 ppm (0,001%)
σε ένα υγρό προϊόν για να το καταστήσει γευστικά ανυπόφορο για τον άνθρωπο,
χωρίς στη συγκέντρωση αυτή να μεταβάλλει κάποια από τις υπόλοιπες χρήσιμες
ιδιότητες του προϊόντος.
Η τοξικότητα του ΒΔ είναι περιορισμένη και δεδομένου ότι οι
απαιτούμενες συγκεντρώσεις του για να καταστήσουν ένα υγρό απωθητικά πικρό
είναι ελάχιστες, θα πρέπει να θεωρηθεί ότι η χρήση του είναι ουσιαστικά
ακίνδυνη για τον άνθρωπο. Έτσι, κατά τις τελευταίες δεκαετίες προστίθεται
σε διάφορα υγρά προϊόντα όπως στη μετουσιωμένη αλκοόλη, στο αντιψυκτικό
υγρό, σε υγρά σαπούνια και σαμπουάν, χρώματα για να εμποδίσει την κατά
λάθος κατάποσή τους, αλλά ακόμη και σε βερνίκια επίπλων για να μην τα γλύφουν
νήπια και να μην τα δαγκώνουν κατοικίδια ζώα. Ακόμη χρησιμοποιείται σε λοσιόν
και σε βερνίκια νυχιών ως μέσο απαλλαγής νηπίων από συνήθειες όπως το
πιπίλισμα των δακτύλων και το "νευρικό" δάγκωμα των νυχιών.
Από το 1995 διάφορες πολιτείες των ΗΠΑ απαίτησαν νομοθετικά την
υποχρεωτική προσθήκη του ΒΔ σε διάφορα προϊόντα και ιδιαίτερα στο αντιψυκτικό
αυτοκινήτων, τα υγρά των καθαριστήρων τζαμιών και σε αλκοόλες (μεθυλική,
ισοπροπυλική) οι οποίες είναι ισχυρά δηλητήρια. Τα αντιψυκτικά των αυτοκινήτων
θεωρούνται ως υπεύθυνα για πολλούς θανάτους (ατυχήματα, αλλά και δολοφονίες),
επειδή ως κύριο συστατικό περιέχουν τη γλυκιά σε γεύση αιθυλενογλυκόλη (HOCH2CH2OH),
η οποία ωστόσο είναι εξαιρετικά τοξική. 'Ετσι, θεωρείται ότι το ΒΔ έχει σώσει τη
ζωή πολλών παιδιών και ζώων που θα μπορούσαν να καταπιούν τέτοια υγρά από
απροσεξία ή λόγω της γλυκιάς τους γεύσης ή της ευχάριστης οσμής τους.