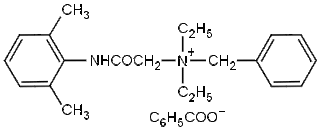Δευτέρα 6 Ιανουαρίου 2020
Κυριακή 5 Ιανουαρίου 2020
Πέμπτη 2 Ιανουαρίου 2020
Η πιο γλυκιά ουσία.
Ποια είναι η πιο γλυκιά ουσία;
 |
| σουκρονικό οξύ |
Το σουκρονικό οξύ βαθμολογείται με
(200.000), αλλά δεν έχει βρει εφαρμογή.
Το ίδιο συμβαίνει και με τις δύο επόμενες
ουσίες που προέρχονται από την ασπαρτάμη – ένα παράγωγό της με θειουρία
(50.000) και τη σουπερασπαρτάμη (8.000).
Η ίδια η ασπαρτάμη εχει μόνο (180), ενώ
η σακχαρίνη (300).
 Οι γλυκαντικές ύλες είναι φυσικές ή χημικές ουσίες, οι οποίες
είναι 150 με 20.000 φορές πιο γλυκές από τη ζάχαρη, ενώ περιέχουν πολύ
μικρή ή και καθόλου θερμιδική αξία. Λόγω της μεγάλης γλυκαντικής τους
ικανότητας, η ποσότητα των γλυκαντικών ουσιών η οποία
είναι απαραίτητη για να προσδώσει γλυκιά γεύση στα διάφορα παρασκευάσματα είναι
πολύ μικρή. Οι γλυκαντικές ύλες μπορούν να υποκαταστήσουν
τη ζάχαρη σε ροφήματα, τσίχλες και γλυκά, χωρίς όμως να έχουν ιδιότητες της
κρυσταλλικής ζάχαρης όπως η σταθερότητα στο ψήσιμο και η παρεμπόδιση της
μικροβιακής ανάπτυξης.
Οι γλυκαντικές ύλες είναι φυσικές ή χημικές ουσίες, οι οποίες
είναι 150 με 20.000 φορές πιο γλυκές από τη ζάχαρη, ενώ περιέχουν πολύ
μικρή ή και καθόλου θερμιδική αξία. Λόγω της μεγάλης γλυκαντικής τους
ικανότητας, η ποσότητα των γλυκαντικών ουσιών η οποία
είναι απαραίτητη για να προσδώσει γλυκιά γεύση στα διάφορα παρασκευάσματα είναι
πολύ μικρή. Οι γλυκαντικές ύλες μπορούν να υποκαταστήσουν
τη ζάχαρη σε ροφήματα, τσίχλες και γλυκά, χωρίς όμως να έχουν ιδιότητες της
κρυσταλλικής ζάχαρης όπως η σταθερότητα στο ψήσιμο και η παρεμπόδιση της
μικροβιακής ανάπτυξης.
Η ασφάλεια των γλυκαντικών ουσιών έχει κατά καιρούς
αμφισβητηθεί, είναι καλό όμως οι καταναλωτές να γνωρίζουν πως οι παγκόσμιες, και εθνικές αρχές διεξάγουν αυστηρούς ελέγχους
για την καταλληλότητα αυτών, προσδιορίζοντας την επιτρεπόμενη χρήση τους, αλλά
και τη συνιστώμενη ημερήσια ποσότητα, που μπορεί κάποιος
να καταναλώσει. Επιπλέον, οι οδηγίες προς τη βιομηχανία τροφίμων και τους
καταναλωτές εξελίσσονται συνεχώς με βάση τα τελευταία επιστημονικά δεδομένα.
Στην Ευρωπαϊκή Ένωση η ελεγκτική αρχή για τις γλυκαντικές ύλες είναι η Ευρωπαϊκή Αρχή Ελέγχου Τροφίμων (EFSA),
η οποία έχει εγκρίνει τη χρήση της ακεσουλφάμης-K,
της ασπαρτάμης, του κυκλαμικού οξέος, της νεοτάμης, της σακχαρίνης, της στέβια,
της σουκραλόζης και της νεότερης αντβαντάμης.
 Η ακεσουλφάμη- Κ (Sunette, Sweet One),
είναι μία χημική γλυκαντική ουσία η οποία περιέχει ακεσουλφάμη και κάλιο. Η
ακεσουλφάμη- Κ όταν καταναλωθεί από μόνη της αφήνει μία άσχημη επίγευση, για
τον λόγο αυτό συνήθως χρησιμοποιείται σε μίγματα γλυκαντικών ουσιών. Δεν απορροφάται από το ανθρώπινο σώμα και κατά συνέπεια δεν
αποδίδει θερμίδες και δεν επηρεάζει τα επίπεδα καλίου στο αίμα. Διαλύεται
στο νερό και χρησιμοποιείται σε προϊόντα τα οποία χρειάζονται ψήσιμο, γι αυτό
άλλωστε και την συναντούμε ως συστατικό σε ποικιλία τροφίμων όπως τα γιαούρτια,
τα παγωτά, οι μαρμελάδες, τα αναψυκτικά και τα dressings. Χρειάζεται να καταναλώσουμε μισό κιλό μαρμελάδας η οποία
περιέχει 1000mg/ κιλό ακεσουλφάμης- Κ για να ξεπεράσουμε την Αποδεκτή Ημερήσια
Πρόσληψη (ΑΗΠ).
Η ακεσουλφάμη- Κ (Sunette, Sweet One),
είναι μία χημική γλυκαντική ουσία η οποία περιέχει ακεσουλφάμη και κάλιο. Η
ακεσουλφάμη- Κ όταν καταναλωθεί από μόνη της αφήνει μία άσχημη επίγευση, για
τον λόγο αυτό συνήθως χρησιμοποιείται σε μίγματα γλυκαντικών ουσιών. Δεν απορροφάται από το ανθρώπινο σώμα και κατά συνέπεια δεν
αποδίδει θερμίδες και δεν επηρεάζει τα επίπεδα καλίου στο αίμα. Διαλύεται
στο νερό και χρησιμοποιείται σε προϊόντα τα οποία χρειάζονται ψήσιμο, γι αυτό
άλλωστε και την συναντούμε ως συστατικό σε ποικιλία τροφίμων όπως τα γιαούρτια,
τα παγωτά, οι μαρμελάδες, τα αναψυκτικά και τα dressings. Χρειάζεται να καταναλώσουμε μισό κιλό μαρμελάδας η οποία
περιέχει 1000mg/ κιλό ακεσουλφάμης- Κ για να ξεπεράσουμε την Αποδεκτή Ημερήσια
Πρόσληψη (ΑΗΠ). Η
ασπαρτάμη (Equal ή NutraSweet), είναι ίσως η πιο αμφισβητημένη γλυκαντική
ουσία, η οποία συγκεντρώνει και τους περισσότερους επικριτές. Η ασπαρτάμη
αποτελείται από δύο αμινοξέα την φαινυλαλανίνη και το ασπαρτικό οξύ, τα οποία
«συνδέονται» με μία αλκοόλη. Όταν η ασπαρτάμη απορροφάται από τον οργανισμό μας
διασπάται στις 3 αυτές ουσίες, τις οποίες το σώμα μας αξιοποιεί ακριβώς όπως θα
το έκανε και μέσω φυσικών πηγών όπως τα γαλακτοκομικά, τα φρούτα και τα
λαχανικά. Επιπρόσθετα οι ποσότητες των τριών
συστατικών της ασπαρτάμης που λαμβάνει σε ημερήσια βάση ο άνθρωπος μέσω των
τροφίμων είναι πολύ μεγαλύτερες από αυτές που θα καταναλώσει κανείς μέσα από
γλυκά και αναψυκτικά τα οποία περιέχουν ασπαρτάμη. Η
ασπαρτάμη αποδίδει 4 θερμίδες ανά γραμμάριο,
λόγω όμως της μεγάλης γλυκαντικής δύναμης χρησιμοποιείται σε εξαιρετικά μικρές
ποσότητες και έτσι η ενεργειακή της αξία θεωρείται αμελητέα. Χρειάζεται να καταναλώσουμε τέσσερα λίτρα αναψυκτικών τα
οποία περιέχουν 2000mg/ λίτρο ασπαρτάμης για να ξεπεράσουμε την ΑΗΠ. Άτομα
με φαινυλ κετονουρία απαγορεύεται να καταναλώσουν ασπαρτάμη λόγω της
περιεκτικότητάς της σε φαινυλαλανίνη. H EFSA
μετά από πρόσφατη ανασκόπηση των τελευταίων επιστημονικών δεδομένων συνεχίζει
να θεωρεί την ασπαρτάμη κατάλληλη για ανθρώπινη κατανάλωση.
Η
ασπαρτάμη (Equal ή NutraSweet), είναι ίσως η πιο αμφισβητημένη γλυκαντική
ουσία, η οποία συγκεντρώνει και τους περισσότερους επικριτές. Η ασπαρτάμη
αποτελείται από δύο αμινοξέα την φαινυλαλανίνη και το ασπαρτικό οξύ, τα οποία
«συνδέονται» με μία αλκοόλη. Όταν η ασπαρτάμη απορροφάται από τον οργανισμό μας
διασπάται στις 3 αυτές ουσίες, τις οποίες το σώμα μας αξιοποιεί ακριβώς όπως θα
το έκανε και μέσω φυσικών πηγών όπως τα γαλακτοκομικά, τα φρούτα και τα
λαχανικά. Επιπρόσθετα οι ποσότητες των τριών
συστατικών της ασπαρτάμης που λαμβάνει σε ημερήσια βάση ο άνθρωπος μέσω των
τροφίμων είναι πολύ μεγαλύτερες από αυτές που θα καταναλώσει κανείς μέσα από
γλυκά και αναψυκτικά τα οποία περιέχουν ασπαρτάμη. Η
ασπαρτάμη αποδίδει 4 θερμίδες ανά γραμμάριο,
λόγω όμως της μεγάλης γλυκαντικής δύναμης χρησιμοποιείται σε εξαιρετικά μικρές
ποσότητες και έτσι η ενεργειακή της αξία θεωρείται αμελητέα. Χρειάζεται να καταναλώσουμε τέσσερα λίτρα αναψυκτικών τα
οποία περιέχουν 2000mg/ λίτρο ασπαρτάμης για να ξεπεράσουμε την ΑΗΠ. Άτομα
με φαινυλ κετονουρία απαγορεύεται να καταναλώσουν ασπαρτάμη λόγω της
περιεκτικότητάς της σε φαινυλαλανίνη. H EFSA
μετά από πρόσφατη ανασκόπηση των τελευταίων επιστημονικών δεδομένων συνεχίζει
να θεωρεί την ασπαρτάμη κατάλληλη για ανθρώπινη κατανάλωση. Το κυκλαμικό οξύ,
χρησιμοποιείται ευρέως από τη βιομηχανία τροφίμων λόγω της μεγάλης σταθερότητας
και διαλυτότητάς του στο νερό. Έχει μικρή γλυκαντική ικανότητα, γι αυτό και
χρησιμοποιείται μαζί με άλλες γλυκαντικές. Δεν απορροφάται από τον οργανισμό,
και ορισμένοι μόνο άνθρωποι μπορούν να το αξιοποιήσουν σαν τροφή για τα
«μικρόβια» που ζουν στο έντερο. Το κυκλαμικό οξύ χρησιμοποιείται σαν
γλυκαντικό μέσο σε ευρεία γκάμα προϊόντων όπως τα αναψυκτικά, το γάλα και οι
χυμοί. Χρειάζεται ενάμιση λίτρο αναψυκτικών τα
οποία περιέχουν 250mg/ λίτρο κυκλαμικού οξέος για να ξεπεράσουμε την ΑΗΠ.
Το κυκλαμικό οξύ,
χρησιμοποιείται ευρέως από τη βιομηχανία τροφίμων λόγω της μεγάλης σταθερότητας
και διαλυτότητάς του στο νερό. Έχει μικρή γλυκαντική ικανότητα, γι αυτό και
χρησιμοποιείται μαζί με άλλες γλυκαντικές. Δεν απορροφάται από τον οργανισμό,
και ορισμένοι μόνο άνθρωποι μπορούν να το αξιοποιήσουν σαν τροφή για τα
«μικρόβια» που ζουν στο έντερο. Το κυκλαμικό οξύ χρησιμοποιείται σαν
γλυκαντικό μέσο σε ευρεία γκάμα προϊόντων όπως τα αναψυκτικά, το γάλα και οι
χυμοί. Χρειάζεται ενάμιση λίτρο αναψυκτικών τα
οποία περιέχουν 250mg/ λίτρο κυκλαμικού οξέος για να ξεπεράσουμε την ΑΗΠ. Η χρήση της νεοτάμης, εγκρίθηκε
από την EFSA μόλις το 2010. Έχει πολύ καθαρή γεύση η οποία πλησιάζει αρκετά
εκείνη της ζάχαρης. Το μόριό της μοιάζει αρκετά με εκείνο της ασπαρτάμης,
μπορεί όμως να καταναλωθεί και από άτομα τα οποία πάσχουν από φαινυλκετονουρία.
Η σταθερότητά της, της επιτρέπει να μπορεί να χρησιμοποιηθεί στην παρασκευή
πολλών προϊόντων όπως οι τσίχλες, τα αναψυκτικά, τα γαλακτοκομικά και οι ζύμες.
Η χρήση της νεοτάμης, εγκρίθηκε
από την EFSA μόλις το 2010. Έχει πολύ καθαρή γεύση η οποία πλησιάζει αρκετά
εκείνη της ζάχαρης. Το μόριό της μοιάζει αρκετά με εκείνο της ασπαρτάμης,
μπορεί όμως να καταναλωθεί και από άτομα τα οποία πάσχουν από φαινυλκετονουρία.
Η σταθερότητά της, της επιτρέπει να μπορεί να χρησιμοποιηθεί στην παρασκευή
πολλών προϊόντων όπως οι τσίχλες, τα αναψυκτικά, τα γαλακτοκομικά και οι ζύμες.
Η
σακχαρίνη είναι
σταθερή στη θερμότητα. [εκκρεμεί παραπομπή] δεν
αντιδρά χημικά με άλλα συστατικά τροφίμων, ως εκ τούτου, αποθηκεύεται εύκολα.
Μείγματα ζαχαρίνης με άλλες γλυκαντικές ουσίες χρησιμοποιούνται συχνά ώστε να
αντισταθμιστούν τυχόν αδυναμίες που έχει σχεδόν κάθε γλυκαντικό. Το μείγμα
10:1 κυκλαμικού νάτριου και
ζαχαρίνης είναι κοινό σε χώρες, όπου και οι δύο αυτές οι γλυκαντικές ουσίες
είναι νόμιμες; σε αυτό το μείγμα, κάθε γλυκαντικό καλύπτει τη γεύση του άλλου.
 Η
σακχαρίνη σε μορφή οξέος δεν είναι υδατοδιαλυτή. Η φόρμα που χρησιμοποιείται ως
τεχνητό γλυκαντικό είναι συνήθως το άλας νατρίου της[3] Το άλας καλίου επίσης,
χρησιμοποιείται μερικές φορές, ειδικά από ανθρώπους που πρέπει να περιορίσουν
την πρόσληψη σε νάτριο. Και τα δύο άλατα είναι ιδιαίτερα υδατοδιαλυτά: 0,67
g/ml νερό σε θερμοκρασία δωματίου.[4][5]
Η
σακχαρίνη σε μορφή οξέος δεν είναι υδατοδιαλυτή. Η φόρμα που χρησιμοποιείται ως
τεχνητό γλυκαντικό είναι συνήθως το άλας νατρίου της[3] Το άλας καλίου επίσης,
χρησιμοποιείται μερικές φορές, ειδικά από ανθρώπους που πρέπει να περιορίσουν
την πρόσληψη σε νάτριο. Και τα δύο άλατα είναι ιδιαίτερα υδατοδιαλυτά: 0,67
g/ml νερό σε θερμοκρασία δωματίου.[4][5]
Στη δεκαετία του 1970, σε μελέτες που
πραγματοποιήθηκαν σε αρουραίους στο
εργαστήριο διαπιστώθηκε συσχέτιση μεταξύ της κατανάλωσης υψηλών δόσεων
ζαχαρίνης και ανάπτυξης καρκίνου της ουροδόχου κύστης.[6] Ωστόσο βάσει περαιτέρω μελέτης
διαπιστώθηκε ότι το αποτέλεσμα αυτό οφείλεται σε ένα μηχανισμό που δεν έχει
σχέση με τον άνθρωπο.[6] Επιδημιολογικές μελέτες
έχουν δείξει ότι δεν υπάρχει απόδειξη ότι η ζαχαρίνη σχετίζεται με τον καρκίνο
της ουροδόχου κύστης σε ανθρώπους.[6][7] Ο Διεθνής
Οργανισμός Έρευνας για τον Καρκίνο (IARC) είχε αρχικά
ταξινομήσει τη ζαχαρίνη στην Ομάδα 2B («πιθανώς καρκινογόνος για τον άνθρωπο»)
με βάση τις μελέτες αρουραίων, αλλά τελικά την υποβάθμισε στην Ομάδα 3 («δεν
έχει ταξινομηθεί ως καρκινογόνα σε ανθρώπους»), κατά την εξέταση των μετέπειτα
ερευνών.[8]
 Η
σακχαρίνη δεν έχει καμία θερμιδική και θρεπτική αξία.[9] Είναι ασφαλές να καταναλώνεται
από άτομα με διαβήτη.[10][11]
Η
σακχαρίνη δεν έχει καμία θερμιδική και θρεπτική αξία.[9] Είναι ασφαλές να καταναλώνεται
από άτομα με διαβήτη.[10][11]
Οι γλυκοζίτες της
στεβιόλης είναι μία γλυκαντική ουσία η οποία βρίσκεται στα
φύλλα του φυτού στέβια (Stevia rebaudiana Bertoni) και είναι
καταλληλότερη από την ασπαρτάμη ή την σακχαρίνη για χρήση σε υγρά ροφήματα.
Συναντάται είτε σε μορφή σκόνης ή σε υγρή μορφή. Η χρήση της εγκρίθηκε μόλις το
2011, και έκτοτε χρησιμοποιείται ευρέως από τη βιομηχανία τροφίμων για στην
παραγωγή δημητριακών, αναψυκτικών και επιτραπέζιων γλυκαντικών σκευασμάτων.
Εάν στο μόριο της κοινής ζάχαρης (σουκρόζη)
αντικαταστήσουμε τρία υδροξύλια με τρία χλώρια τότε προκύπτει η σουκραλόζη. Η σουκραλόζη είναι τεχνητή γλυκαντική ουσία που χρησιμοποιείται ως υποκατάστατο της ζάχαρης. Η πλειονότητα της προσλαμβανόμενης σουκραλόζης δεν
διασπάται από το σώμα, συνεπώς είναι μη θερμιδούχος.[4] Στην Ευρωπαϊκή Ένωση, είναι επίσης γνωστή με τον κωδικό τροφίμων Ε955. Παράγεται με τη χλωρίωση της ζάχαρης. Η σουκραλόζη
είναι περίπου 320 έως 1.000 φορές πιο γλυκιά από τη σακχαρόζη,[5] τρεις φορές
γλυκύτερη από την ασπαρτάμη και ακεσουλφάμη καλίου, και δύο φορές πιο γλυκιά από τη ζαχαρίνη. Τα αποδεικτικά
στοιχεία για τη μακροπρόθεσμη απώλεια βάρους είναι ελλιπή, ενώ
υπάρχουν και κάποια που υποστηρίζουν την αύξηση βάρους και τους κινδύνους
καρδιακής νόσου.[6]
 Η αντβαντάμη είναι η πιο πρόσφατη
προσθήκη στον κατάλογο των επιτρεπόμενων για ανθρώπινη χρήση γλυκαντικών
ουσιών.
Η αντβαντάμη είναι η πιο πρόσφατη
προσθήκη στον κατάλογο των επιτρεπόμενων για ανθρώπινη χρήση γλυκαντικών
ουσιών.
Αντβαντάμη
είναι ένα μείγμα από βανιλίνη και ασπαρτάμη και λέγεται ότι είναι 37.000 φορές
πιο γλυκιά από τη ζάχαρη.
Ενδείκνυται για χρήση τόσο σε τρόφιμα τα οποία
υφίστανται επεξεργασία/ προετοιμασία σε υψηλές θερμοκρασίες, όσο και για χρήση
σαν επιτραπέζιο γλυκαντικό μέσο.
Η ΠΙΟ ΠΙΚΡΗ ΟΥΣΙΑ
Ποια είναι η πιο πικρή ουσία;
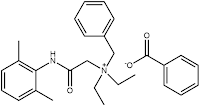
Δενατόνιο (βενζοϊκό)
Βενζοϊκό Ν-βενζυλο-2-(2,6-διμεθυλοφαινυλαμινο)-Ν,Ν-διαιθυλο-2-οξοαιθαναμίνιο
Denatonium benzoate (BitrexTM)
N-benzyl-2-(2,6-dimethylphenylamino)-N,N-diethyl-2-oxoethanaminium
benzoate
Μοριακός
τύπος: C21H29Ν2O.C7H5O2
Σχετική
μοριακή μάζα: 446,58
Σημείο
τήξης: 166-170οC
pH υδατ. διαλύματος 3%: 6,5-7,5
Διαλυτότητα
(g/100 mL, στους 20οC):
- Νερό:
4,5
-
Αιθανόλη: 33,5
-
Βουτανόλη: 20,8
-
Ακετόνη: 1,4
-
Αιθέρας: 0,015
-
Βενζόλιο: 0,49
Βενζοϊκό δενατόνιο:
Η ένωση βενζοϊκό δενατόνιο (ΒΔ) (denatonium benzoate) έχει την εξαιρετικά
ενδιαφέρουσα ιδιότητα να είναι η ουσία με την πιο ισχυρή πικρή γεύση μεταξύ των
γνωστών χημικών ουσιών. Από χημική άποψη πρόκειται για ένα άλας
αποτελούμενο από ένα οργανικό κατιόν τεταρτοταγούς αμμωνίου και από ένα
οργανικό ανιόν, το ανιόν του βενζοϊκού οξεός. Tο βενζοϊκό ανιόν δεν
συνεισφέρει ουσιαστικά στην πικρή γεύση της ένωσης και συχνά
αντικαθίσταται από το ανιόν της συνθετικής γλυκαντικής ύλης σακχαρίνης
(denatonium saccharide) [Αναφ.
3-5]. Η ονομασία της ένωσης προέρχεται από τη
λέξη "denaturation" (μετουσίωση) και την κατάληξη "onium"
που υποδηλώνει κατιόν τεταρτοταγούς αμμωνίου (R4N+).
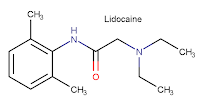
Το ΒΔ ανακαλύφθηκε το 1958 (MacFarlan Smith, Εδιμβούργο) κατά τη διάρκεια πειραμάτων παρασκευής νέων
αναισθητικών ουσιών. Η δομή του δενατονίου μοιάζει αρκετά με το τοπικό
αναισθητικό λιδοκαΐνη (lidocaine)
(γνωστή και ως ξυλοκαΐνη), η οποία έχει επίσης εξαιρετικά πικρή
γεύση και διαθέτει ουσιαστικά την ίδια χημική δομή και υπολείπεται μόνο κατά
μία βενζυλική ομάδα (-CH2C6H5).
Που
χρησιμοποιείται;
Μια από τις κυριότερες χρήσεις του ΒΔ είναι η μετουσίωση της
αιθανόλης. Έτσι, στην αιθανόλη η οποία χρησιμοποιείται ως διαλύτης ή καύσιμο
("φωτιστικό οινόπνευμα" ή "μπλε οινόπνευμα"), προστίθεται
μεθανόλη, πυριδινικές ενώσεις, πετρέλαιο, χρώμα και άλλα συστατικά (νομοθετικώς
προβλεπόμενα από κάθε κράτος) για να αποτραπεί η παράνομη χρήση της για την
παρασκευή αλκοολούχων ποτών, εφόσον η αιθανόλη για τη χρήση αυτή υπόκειται σε
υψηλούς φόρους. Πολλοί εθνικοί κανονισμοί προβλέπουν και την προσθήκη ΒΔ για να
αποτραπεί η κατά λάθος κατάποση της μετουσιωμένης αιθανόλης.
Στο εμπόριο το ΒΔ διατίθεται ως καθαρή ένωση με την εμπορική ονομασία BITREX (από
το bitter: πικρό) ή AVERSION (aversion: αποστροφή,
αντιπάθεια), αλλά και ως διάλυμα 20% σε αιθανόλη ή αιθυλενογλυκόλη.
Η χρήση του ΒΔ είναι υποχρεωτική σε ορισμένα τοξικά προϊόντα για
λόγους ασφαλείας, γιατί τα καθιστά τόσο πικρά και απωθητικά στη γεύση που ο
άνθρωπος ή τα ζώα δεν μπορούν να τα καταπιούν. Χαρακτηριστικά αναφέρεται
ότι η πικρή γεύση του ΒΔ γίνεται αντιληπτή ακόμη και σε αραίωση 1:50.000.000.
Συνήθως επαρκεί μια συγκέντρωση 10 ppm (0,001%)
σε ένα υγρό προϊόν για να το καταστήσει γευστικά ανυπόφορο για τον άνθρωπο,
χωρίς στη συγκέντρωση αυτή να μεταβάλλει κάποια από τις υπόλοιπες χρήσιμες
ιδιότητες του προϊόντος.
Η τοξικότητα του ΒΔ είναι περιορισμένη και δεδομένου ότι οι
απαιτούμενες συγκεντρώσεις του για να καταστήσουν ένα υγρό απωθητικά πικρό
είναι ελάχιστες, θα πρέπει να θεωρηθεί ότι η χρήση του είναι ουσιαστικά
ακίνδυνη για τον άνθρωπο. Έτσι, κατά τις τελευταίες δεκαετίες προστίθεται
σε διάφορα υγρά προϊόντα όπως στη μετουσιωμένη αλκοόλη, στο αντιψυκτικό
υγρό, σε υγρά σαπούνια και σαμπουάν, χρώματα για να εμποδίσει την κατά
λάθος κατάποσή τους, αλλά ακόμη και σε βερνίκια επίπλων για να μην τα γλύφουν
νήπια και να μην τα δαγκώνουν κατοικίδια ζώα. Ακόμη χρησιμοποιείται σε λοσιόν
και σε βερνίκια νυχιών ως μέσο απαλλαγής νηπίων από συνήθειες όπως το
πιπίλισμα των δακτύλων και το "νευρικό" δάγκωμα των νυχιών.
Από το 1995 διάφορες πολιτείες των ΗΠΑ απαίτησαν νομοθετικά την
υποχρεωτική προσθήκη του ΒΔ σε διάφορα προϊόντα και ιδιαίτερα στο αντιψυκτικό
αυτοκινήτων, τα υγρά των καθαριστήρων τζαμιών και σε αλκοόλες (μεθυλική,
ισοπροπυλική) οι οποίες είναι ισχυρά δηλητήρια. Τα αντιψυκτικά των αυτοκινήτων
θεωρούνται ως υπεύθυνα για πολλούς θανάτους (ατυχήματα, αλλά και δολοφονίες),
επειδή ως κύριο συστατικό περιέχουν τη γλυκιά σε γεύση αιθυλενογλυκόλη (HOCH2CH2OH),
η οποία ωστόσο είναι εξαιρετικά τοξική. 'Ετσι, θεωρείται ότι το ΒΔ έχει σώσει τη
ζωή πολλών παιδιών και ζώων που θα μπορούσαν να καταπιούν τέτοια υγρά από
απροσεξία ή λόγω της γλυκιάς τους γεύσης ή της ευχάριστης οσμής τους.
2. RC Pharmachem: "Denatonium benzoate: Material Safety Data Sheet"
3. All Experts: "Denatonium: Encyclopedia".
4. C-TECH Corporation: "Bitrex-Denatonium benzoate".
5. Wikipedia: "Denatonium".
6. Umami Information Center: "What is umami?".
7. Tim Jacob: "Taste - A brief tutorial".
8. BBC: Science & Nature (Human Body and Mind): "Test your tastebuds".
9. Colorado State University: "Physiology of taste".
10. Wikipedia: "Basic taste".
11. Wikipedia: "Phenylthiocarbamide".
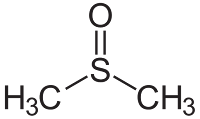
ΘΕΙΟΑΚΕΤΟΝΗ
(CH3) 2C = S
Η θειοακετόνη είναι
μια ένωση οργανικού θείου με τον χημικό τύπο (CH3) 2CS.
Πάνω από -20 ° C
(-4 ° F), η θειοακετόνη μετατρέπεται εύκολα σε ένα πολυμερές και ένα τριμερές
τριθειοακετόνη. [3]
Έχει
μια εξαιρετικά ισχυρή, δυσάρεστη οσμή.
Properties
|
|
C3H6S
|
|
74.14 g·mol−1
|
|
Appearance
|
Brown liquid
|
Extremely
unpleasant, putrid odor
|
|
Παρασκευή
Η θειοακετόνη
ελήφθη για πρώτη φορά το 1889 από τους Baumann και Fromm, ως μικρή πρόσμειξη
στη σύνθεση της τριθειοακετόνης. [1]
Η θειοακετόνη συνήθως λαμβάνεται με πυρόλυση της κυκλικής
τριμερούς τριαιθοακετόνης [(CH3) 2CS] 3.
Το τριμερές
παρασκευάζεται με πυρόλυση αλλυλο ισοπροπυλ σουλφιδίου ή με κατεργασία ακετόνης
με υδρόθειο παρουσία ενός οξέος Lewis [4] [5]
Η τριμερής ρωγμή στους 500-600 ° C (932-1,112 ° F) για να
δώσει τη θειόνη. [2] [6] [1]
Πολυμερισμός
Η θειοακετόνη πολυμερίζεται αυθόρμητα ακόμη και σε πολύ
χαμηλές θερμοκρασίες, καθαρή ή διαλελυμένη σε αιθέρα ή αιθυλενοξείδιο,
αποδίδοντας ένα λευκό στερεό που είναι ένα μεταβαλλόμενο μίγμα γραμμικού
πολυμερούς [C (CH3)2-S-]n- ··· και η κυκλική τριμερής
τριθειοακετόνη.
Το μέσο μοριακό βάρος του πολυμερούς κυμαίνεται από 2000
έως 14000 ανάλογα με τη μέθοδο παρασκευής, τη θερμοκρασία και την παρουσία του
ταυτομερούς θειοενόλης. Το πολυμερές
τήκεται στην περιοχή ή περίπου 70 ° C έως 125 ° C. Ο πολυμερισμός προωθείται
από τις ελεύθερες ρίζες και το φως. [1]
Το κυκλικό τριμερές της θειοακετόνης (τριθειοακετόνη)
είναι μια λευκή ή άχρωμη ένωση με σημείο τήξης 24 ° C (75 ° F), κοντά στη θερμοκρασία
δωματίου. Έχει επίσης μια δυσάρεστη οσμή. (3)
Οσμή
Η θειοακετόνη έχει έντονα άσχημη οσμή. Όπως και πολλές
ενώσεις οργανικού θείου χαμηλού μοριακού βάρους, η μυρωδιά είναι ισχυρή και
μπορεί να ανιχνευθεί ακόμη και όταν είναι πολύ αραιωμένη [7]. Το 1889
μια προσπάθεια απόσταξης της χημικής ουσίας στη γερμανική πόλη Freiburg
ακολουθήθηκε από περιπτώσεις εμέτου, ναυτίας και απώλειας συνειδητοποίησης σε
μια περιοχή με ακτίνα 0,75 χιλιομέτρων γύρω από το εργαστήριο λόγω της οσμής [8].
Οι Βρετανοί χημικοί στο Whitehall Soap Works στο Λιντς σημείωσαν σε έκθεση του
1890 ότι η αραίωση φαινόταν να καταστήσει τη μυρωδιά χειρότερη και περιέγραψε
τη μυρωδιά ως "φόβος" [9].
 Η θειοακετόνη θεωρείται επικίνδυνη χημική ουσία λόγω της
εξαιρετικά άσχημης οσμής και της ικανότητάς της να καθιστά τους ανθρώπους
ασυνείδητους, να προκαλεί εμετό και να ανιχνεύεται σε μεγάλες αποστάσεις.
Η θειοακετόνη θεωρείται επικίνδυνη χημική ουσία λόγω της
εξαιρετικά άσχημης οσμής και της ικανότητάς της να καθιστά τους ανθρώπους
ασυνείδητους, να προκαλεί εμετό και να ανιχνεύεται σε μεγάλες αποστάσεις.
Το 1967, οι ερευνητές της Esso επανέλαβαν το πείραμα της
θραύσης θειοακετόνης, σε εργαστήριο νότια της Οξφόρδης, .
Αναφέρθηκαν στην εμπειρία τους ως εξής:
«Πρόσφατα βρήκαμε ένα πρόβλημα οσμής πέρα από τις
χειρότερες προσδοκίες μας. Κατά τη διάρκεια των πρώιμων πειραμάτων, ένα πώμα
πήδηξε από ένα μπουκάλι υπολειμμάτων και, αν και αντικαταστάθηκε αμέσως, είχε
ως αποτέλεσμα την άμεση καταγγελία της ναυτίας και της αρρώστιας από τους
συναδέλφους που εργάζονταν σε ένα κτίριο 200 μέτρα μακριά. Δύο από τους
χημικούς μας, οι οποίοι δεν έκαναν τίποτε άλλο από το να διερευνήσουν τη οσμή μικρών
ποσοτήτων τριθειοακετόνης, βρήκαν τον εαυτό τους αντικείμενο εχθρικών ενεργειών
σε ένα εστιατόριο .»
ΠΑΡΑΠΟΜΠΕΣ:
1.
William H. Sharkey (1979): "Polymerization through the carbon-sulfur
double bond". Polymerization, series Advances in
Polymer Science, volume 17, pages 73-103. doi:10.1007/3-540-07111-3_2
2. ^ Jump up to:a b V.C.E. Burnop;
K.G. Latham (1967). "Polythioacetone
Polymer". Polymer. 8: 589–607. doi:10.1016/0032-3861(67)90069-9.
3. ^ Jump up to:a b R.D. Lipscomb;
W.H. Sharkey (1970). "Characterization and polymerization of
thioacetone". Journal of Polymer Science Part A: Polymer
Chemistry. 8 (8): 2187–2196. doi:10.1002/pol.1970.150080826.
4. ^ Bailey, William
J.; Chu, Hilda (1965). "Synthesis of
polythioacetone". ACS Polymer Preprints. 6: 145–155.
5. ^ Bohme, Horst;
Pfeifer, Hans; Schneider, Erich (1942). "Dimeric
thioketones". Berichte der Deutschen Chemischen Gesellschaft. 75B (7):
900–909. doi:10.1002/cber.19420750722. Note: This early report mistakes the
trimer for the monomer
6. ^ Kroto, H.W.;
Landsberg, B.M.; Suffolk, R.J.; Vodden, A. (1974). "The photoelectron and
microwave spectra of the unstable species thioacetaldehyde, CH3CHS, and thioacetone,
(CH3)2CS". Chemical Physics Letters. 29 (2):
265–269. doi:10.1016/0009-2614(74)85029-3. ISSN 0009-2614.
7. ^ Jump up to:a b Derek Lowe (June 11, 2009). "Things I
Won't Work With: Thioacetone". In The Pipeline.
8. ^ E. Baumann &
E. Fromm (1889). "Ueber Thioderivate der Ketone" (PDF). Berichte der Deutschen Chemischen Gesellschaft. 22 (2):
2592–2599. doi:10.1002/cber.188902202151.
Εγγραφή σε:
Αναρτήσεις (Atom)